Larutan Asam
dan Basa
Glossary
Pengertian Larutan
Pernahkah Anda membuat sirup? Sirup dapat dibuat dengan mencampurkan gula pasir dan air. Apabila gula pasir dimasukkan dalam air dan diaduk maka padatan gula pasir akan menghilang. Kemanakah perginya gula pasir? Ambillah segelas air sirup. Dengan bantuan sedotan, rasakan sirup dibagian dasar gelas, tengah gelas dan permukaan gelas, bagaimana rasanya? Apakah ada perbedaan rasa? Amati warna sirup di seluruh bagian, apakah ada perbedaan? Sirup merupakan salah satu contoh larutan.
Larutan merupakan campuran yang homogen, yaitu campuran yang memiliki komposisi merata atau serba sama di seluruh bagian volumenya. Apa saja komponen dari larutan? Suatu larutan mengandung dua komponen atau lebih yang disebut zat terlarut (solut) dan pelarut (solven). Zat terlarut merupakan komponen yang jumlahnya sedikit, sedangkan pelarut adalah komponen yang terdapat dalam jumlah banyak. Pada contoh di atas, air merupakan pelarut sedangkan gula merupakan zat terlarut.
Meskipun larutan dapat mengandung banyak komponen, tetapi pada pembahasan materi ini dibatasi hanya larutan dengan dua macam komponen yaitu larutan biner. Komponen dari larutan biner yaitu zat terlarut dan pelarut yang dapat dilihat dalam Tabel 1.
Proses Pembentukan Larutan
Proses terjadinya suatu larutan dapat mengikuti salah satu mekanisme berikut: (a) Zat terlarut bereaksi secara kimia dengan pelarut dan membentuk zat yang baru, (b) Zat terlarut membentuk zat tersolvasi dengan pelarut,
(c) Terbentuknya larutan berdasarkan dispersi.
Reaksi kimia dengan pelarut dapat terjadi apabila ada interaksi antara pelarut dan zat terlarut dengan pemutusan satu atau lebih ikatan kimia. Contoh dari gejala ini adalah:
Pada contoh diatas terbentuk sistem homogen tetapi sifat kimia zat terlarut berubah. Golongan yang kedua, masih menunjukkan adanya antaraksi antarpelarut dan zat terlarut, tetapi tidak sekuat golongan yang pertama dan tidak disertai perubahan sifat dari zat terlarut. Antaraksi yang terjadi ialah bentuk solvasi, dan dinamakan hidratasi jika pelarutnya air. Solvasi biasanya disebabkan karena adanya antaraksi antara pelarut polar terhadap zat terlarut yang polar pula, seperti bila garam NaCl dilarutkan dalam air (lihat Gambar 1).
Molekul air sebagai dwikutub mengelilingi ion-ion Na+ dan Cl- seperti tampak pada Gambar. Dalam hal ini dikatakan ion-ion Na+ dan Cl- dalam kedaan tersolvasi. Solvasi dapat pula terjadi antara molekul yang polar, misalnya etanol C2H5OH dengan air. Oleh karena itu alkohol dapat larut dalam air. Sedangkan, proses terjadinya larutan berdasarkan dispersi dapat ditunjukkan oleh CCl4 dan benzena. Kedua molekul ini non polar sehingga tidak ada gaya tarik menarik antara kedua zat tersebut. Kelarutan dalam hal ini disebabkan karena adanya kecenderungan dari benzena dan karbon tetraklorida untuk terdispersi sejauh mungkin.
Jenis-jenis Larutan
Bermacam-macam larutan dapat diklasifikasikan berdasarkan tingkat kelarutan, konsentrasi zat terlarut dan daya hantar listrik. Berikut kita bahas jenis larutan berdasarkan konsentrasi zat terlarut, kelarutan daya hantar larutan secara terpisah.
1. Konsentrasi Zat Terlarut
Apakah Anda pernah membuat teh pada pagi atau sore hari? The bagaimana yang Anda inginkan, yang pekat atau yang encer? Bila Anda senang teh yang pekat, pasti banyak ekstrak teh yang Anda larutkan dalam pelarut air, sebaliknya bila Anda senang teh encer, hanya sedikit ekstrak teh yang Anda larutkan dalam air.
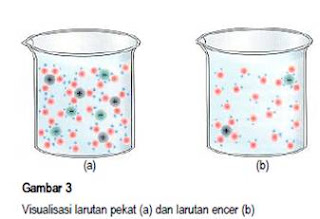
Dalam pembuatan larutan di laboratorium, kita kenal istilah “konsentrasi”. Bila larutan pekat berarti konsentrasinya tinggi, dan bila larutan encer berarti larutan tersebut mempunyai konsentrasi rendah. Larutan dengan konsentrasi tinggi berarti memerlukan lebih banyak zat terlarut daripada larutan dengan konsentrasi rendah. Lebih jelasnya perhatikan Gambar 3 untuk memvisualisasikan perbedaan larutan pekat dan larutan encer.
2. Kelarutan
Pengertian Kelarutan
Kita sering melarutkan suatu bahan untuk beberapa keperluan. Kadang-kadang ada bahan yang sukar larut dan ada juga bahan yang mudah larut. Umumnya zat terlarut larut dalam pelarut tertentu dan temperatur tertentu. Misalnya, hanya 4,74 g kalium iodat, KIO3 yang larut dalam 100 g air pada 00C. Bila kita tambahkan 4,74 g KIO3 ke dalam air pada temperatur tersebut, terdapat kelebihan jumlah KIO3 yang tidak
larut. Maka dapat kita katakan bahwa kelarutan KIO3 dalam air pada 00C adalah 4,74 g per 100 g air.
Dari uraian di atas, banyaknya zat terlarut maksimal yang dapat larut dalam jumlah tertentu pelarut pada temperatur konstan disebut kelarutan. Kelarutan suatu zat tergantung pada suhu, volume pelarut, dan ukuran zat terlarut.
Suatu larutan dengan jumlah maksimum zat terlarut pada temperatur tertentu disebut larutan jenuh. Sebelum mencapai titik jenuh, disebut larutan tidak jenuh. Sedangkan suatu keadaan dengan zat terlarut lebih banyak dari pada pelarut, disebut larutan lewat jenuh. Jadi , larutan yang mengandung 2 g KIO3 dalam 100 g air pada
00C adalah larutan tidak jenuh.
Perhatikan uraian berikut. Pada 1000C, kelarutan KIO3 dalam air adalah 32,3 g per 100 g air. Jika larutan yang mengandung 32,3 g KIO3 dalam 100 g air pada 1000C tersebut, kita dinginkan pada 00c, ternyata hanya 4,74 g KIO3 yang masih dalam keadaan larut, dan 27,6 g KIO3 akan membentuk kristal dalam larutan. Proses ini disebut rekristalisasi. Terbentuknya kristal zat terlarut dalam larutan, dapat terjadi bila kita menambahkan sedikit zat terlarut padat pada larutan lewat jenuh seperti ditunjukkan dalam Gambar 4.
Pelarut yang sering digunakan adalah air. Hal ini disebabkan karena air merupakan zat yang mudah di dapat dan mempunyai kemampuan tinggi untuk melarutkan zat. Jika kita sedang memasak sayur, bermacam-macam bumbu kita masukkan untuk mendapatkan rasa yang sedap. Rasa tersebut merupakan kombinasi rasa dari beberapa macam bumbu yang telah terlarut dalam air (kuah). Karena kemampuan yang tinggi dalam melarutkan zat, air dinamakan sebagai “pelarut universal”. Di dalam tubuh kita pun air melarutkan makanan sehingga mudah dicerna. Apakah semua zat melarut sama baiknya di dalam air? Untuk menjawab pertanyaan ini, coba perhatikan Tabel 2 berikut.
Berdasarkan Tabel 2 di atas, dapat diungkapkan bahwa kelarutan berbagai macam zat dalam air tidak sama. Bandingkan kelarutan gula dan garam dalam air. Mana yang lebih mudah melarut? Mengapa kelarutan zat berbeda-beda? Faktor-faktor apa yang mempengaruhinya? Perhatikan Gambar 5, Anda pasti akan menemukan jawabannya. Selain suhu, factor-faktor yang mempengaruhi kelarutan adalah pengadukan (Gambar 5a), dan ukuran zat terlarut (luas permukaan sentuhan zat terlarut) (Gb. 5b).
Faktor-faktor yang Mempengaruhi Kelarutan
Suhu
Suhu mempengaruhi kelarutan suatu zat. Bayangkan dalam gedung bioskop yang banyak penonton sedang asyik menonton film dan tiba-tiba gedung tersebut terbakar. Pasti keadaan orang-orang tersebut akan berbeda, dari keadaan tenang menjadi saling berdesakan dan menyebar. Demikian pula pada suhu tinggi partikel-partikel akan bergerak lebih cepat dibandingkan pada suhu rendah. Akibatnya kontak antara zat terlarut dengan pelarut menjadi lebih sering dan efektif. Hal ini menyebabkan zat terlarut menjadi lebih mudah larut pada suhu tinggi. Perhatikan Gambar 6, terlihat kelarutan KNO3 sangat berpengaruh oleh kenaikan suhu, sedangkan KBr kecil sekali. Jika campuran ini dimasukkan air panas, maka kelarutan KNO3 lebih besar daripada KBr sehingga KBr lebih banyak mengkristal pada suhu tinggi, dan KBr dapat dipisahkan dengan menyaring dalam keadaan panas.
Jika kelarutan zat padat bertambah dengan kenaikan suhu, maka kelarutan gas berkurang bila suhu dinaikkan, karena gas menguap dan meninggalkan pelarut. Ikan akan mati dalam air panas karena kelarutan oksigen berkurang. Minuman akan mengandung CO2 lebih banyak bila disimpan dalam lemari es dibandingkan di udara terbuka.
Pengadukan
Pengadukan juga menentukan kelarutan zat terlarut. Semakin banyak jumlah pengadukan, maka zat terlarut umumnya menjadi lebih mudah larut.
Luas Permukaan Sentuhan Zat
Kecepatan kelarutan dapat dipengaruhi juga oleh luas permukaan (besar kecilnya partikel zat terlarut). Luas permukaan sentuhan zat terlarut dapat di diperbesar melalui proses pengadukan atau penggerusan secara mekanis. Gula halus lebih mudah larut daripada gula pasir. Hal ini karena luas bidang sentuh gula halus lebih luas dari gula pasir, sehingga gula halus lebih mudah berinteraksi dengan air.
3. Daya Hantar Listrik
Dalam kehidupan sehari-hari mungkin Anda pernah menjumpai orang yang kurang bertanggung jawab terhadap lingkungan, yaitu menangkap ikan dengan menggunakan strom listrik. Dengan alat tersebut mereka memasukkan aliran listrik ke dalam air sungai atau air laut. Mengapa air sungai tersebut dapat menghantarkan arus listrik dan ikan dapat tertraik oleh aliran listrik tersebut? Dalam air sungai terdapat zat-zat terlarut dan ternyata sebagian dari zat terlarut itu ada yang dapat menghantarkan arus listrik. Hal itu terbukti dengan adanya ikan yang mati akibat sengatan arus listrik.
Air murni merupakan penghantar listrik yang buruk. Akan tetapi jika dalam air tersebut ditambahkan zat terlarut maka sifat daya hantarnya akan berubah sesua dengan jenis zat yang dilarutkan. Contoh, jika dalam air ditambahkan garam dapur, maka larutan ini akan dapat menghantarkan listrik dengan baik. Tetapi jika dalam air ditambahkan gula pasir, maka daya hantar listriknya tidak berbeda dengan air murni.
Larutan Elektrolit dan Non-Elektrolit
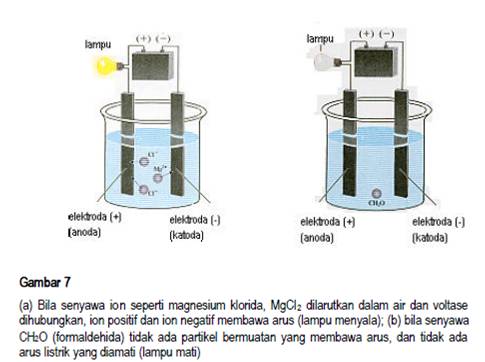
Berdasarkan sifat daya hantar listriknya, larutan dibagi menjadi dua yaitu larutan elektrolit dan larutan non elektrolit. Sifat elektrolit dan non elektrolit didasarkan pada keberadaan ion dalam larutan yang akan mengalirkan arus listrik. Jika dalam larutan terdapat ion, larutan tersebut bersifat elektrolit. Jika dalam larutan tersebut tidak terdapat ion larutan tersebut bersifat non elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Hantaran listrik melalui larutan dapat dtunjukkan dengan alat uji elektrolit seperti pada Gambar 7. Jika larutan menghantarkan arus listrik, maka lampu dalam rangkaian tersebut akan menyala dan timbul gas atau endapan pada salah satu atau kedua elektroda.
Contoh lain adalah, bila NaCl dilarutan dalam air akan terurai menjadi ion positif dan ion negatif. Ion positif yang dihasilkan dinamakan kation dan ion negatif yang dihasilkan dinamakan anion. Larutan NaCl adalah contoh larutan elektrolit. Perhatikan reaksi berikut.
Bila gula dilarutkan dalam air, molekul-molekul gula tersebut tidak terurai menjadi ion tetapi hanya berubah wujud dari padat menjadi larutan. Larutan gula adalah contoh dari larutan non elektrolit. Perhatikan reaksi berikut: 

Dalam kehidupan sehari-hari kita banyak menemukan contoh larutan elektrolit maupun non elektrolit. Contoh larutan elektrolit: larutan garam dapur, larutan cuka makan, larutan asam sulfat, larutan tawas, air sungai, air laut. Contoh larutan non elektrolit adalah larutan gula, larutanurea, larutan alkohol, larutan glukosa.
Elektrolit Kuat dan Elektrolit Lemah
Daya hantar listrik larutan elektrolit bergantung pada jenis dan konsentrasinya. Beberapa larutan elektrolit dapat menghantarkan arus listrik dengan baik meskipun konsentrasinya kecil, larutan ini dinamakan elektrolit kuat. Sedangkan larutan elektrolit yang mempunyai daya hantar lemah meskipun konsentrasinya tinggi dinamakan elektrolit lemah.
Perhatikan hasil uji elektrolit yang ditunjukkan pada Gambar 8. Pada larutan elektrolit lampu yang digunakan menyala dan timbul gas pada elektrodanya. Beberapa larutan elektrolit dapat mengahantarkan listrik dengan baik sehingga lampu menyala terang dan gas yang terbentuk relatif banyak (Gambar 8a). Larutan ini dinamakan elektrolit kuat, beberapa elektrolit yang lain dapat menghantarkan listrik tetapi kurang baik, sehingga lampu nyala, redup atau bahkan tidak menyala dan gas yang terbentuk relatif sedikit. (Gambar 8b). Dari uraian di atas kita dapat golongkan larutan elektrolit menjadi dua macam, yaitu elektrolit kuat dan elektrolit lemah.
Larutan elektrolit kuat adalah larutan yang dapat menghantarkan arus listrik dengan baik. Hal ini disebabkan karena zat terlarut akan terurai sempurna (derajat ionisasi α = 1) menjadi ion-ion sehingga dalam larutan tersebut banyak mengandung ion-ion.
Sebagai contoh larutan NaCl. Jika padatan NaCl dilarutkan dalam air maka NaCl akan terurai sempurna menjadi ion Na+ dan Cl-. Perhatikan reaksi berikut.
NaCl (aq)-------- Na+ (aq) + Cl- (aq)
Dari reaksi diatas jika 100 mol NaCl dilarutkan dalam air akan terbentuk 100 mol ion Na+ dan 100 mol ion Cl-. Jadi jika 100 mol NaCl dilarutkan akan terbentuk 200 mol ion.
Larutan elektrolit lemah adalah larutan yang dapat menghantarkan arus listrik dengan lemah. Hal ini disebabklan karena zat terlarut akan terurai sebagian (α << 1) menjadi ion-ion sehingga dalam larutan tersebut sedikit mengandung ion.
Tabel berikut menggambarkan larutan-larutan yang termasuk elektrolit kuat, elektrolit lemah dan non elektrolit.
c. Rangkuman
v Larutan adalah campuran zat-zat homogen, terdiri dari dua komponen
atau lebih yang disebut zat terlarut (solut) dan pelarut (solvent). Suatu
larutan dapat dibedakan sebagai larutan jenuh, tidak jenuh dan lewat
jenuh.
v Mekanisme dalam proses pembentukan suatu larutan adalah: (a) Zat
terlarut bereaksi secara kimia dengan pelarut dan membentuk zat yang
baru, (b) Zat terlarut membentuk zat tersolvasi dengan pelarut, (c)
Terbentuknya larutan berdasarkan dispersi.
v Larutan dengan konsentrasi tinggi disebut larutan pekat, sedangkan
larutan dengan konsentrasi rendah disebut larutan encer.
v Kelarutan adalah banyaknya zat terlarut maksimal yang dapat larut dalam
jumlah tertentu pelarut pada temperatur konstan. Kelarutan dipengaruhi
oleh suhu, pengadukan dan luas permukaan zat.
v Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik.
v Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan
arus listrik.
v Larutan elektrolit kuat adalah larutan yang dapat menghantarkan arus
listrik dengan baik, karena zat terlarutnya terurai sempurna (derajat
ionisasi ? = 1) menjadi ion-ion sehingga dalam larutan tersebut banyak
mengandung ion-ion.
v Larutan elektrolit lemah adalah larutan yang dapat menghantarkan arus
listrik dengan lemah, karena zat terlarut terurai sebagian (? << 1)
menjadi ion-ion sehingga dalam larutan tersebut sedikit mengandung ion.



















0 komentar:
Posting Komentar